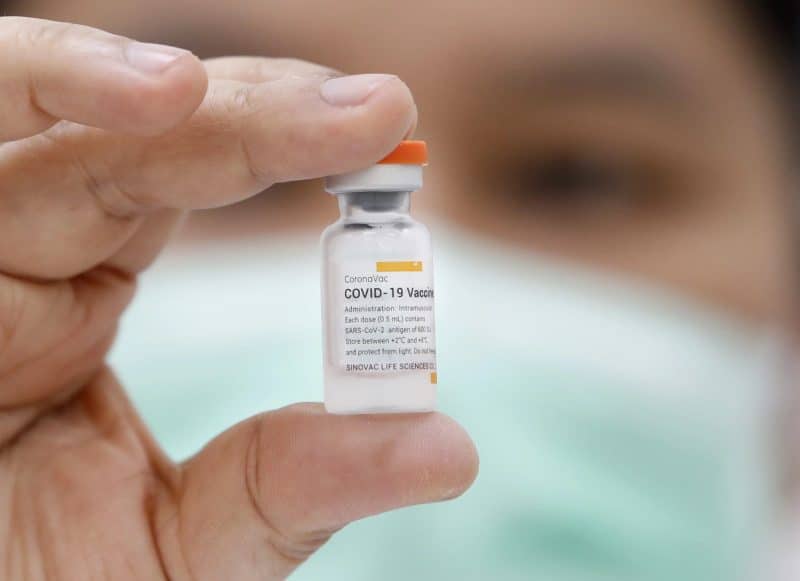
A Agência Nacional de Vigilância Sanitária (Anvisa) anunciou na noite desta quarta-feira, 18/08, que a primeira avaliação do pedido de ampliação da faixa etária de indicação da vacina CoronaVac, contra o Covid-19, feito no dia 30 de julho pelo Instituto Butantan, não foi aprovado. Dessa forma, por enquanto, não há imunizante aprovado no Brasil para vacinar crianças abaixo de 12 anos. Além disso, por enquanto, o único imunizante aprovado para uso em crianças de 12 a 18 anos até o momento no País é o da Pfizer.
É importante ressaltar que a Anvisa solicitou novos dados ao Butantan e que vai prosseguir analisando o uso da CoronaVac para crianças de 3 a 17 anos. Segunda a Anvisa, com as informações apresentadas pelo Butantan no pedido em questão, não foi possível concluir sobre a eficácia e a segurança da vacina nessa faixa etária. “Os dados de imunogenicidade deixam incertezas sobre a duração da proteção conferida pelo imunizante”, informou a agência.
O anúncio foi feito pela Diretoria Colegiada (Dicol) da Anvisa nesta quarta-feira, 18/8, durante a 15ª Reunião Extraordinária do ano de 2021 (assista aqui). A Anvisa informou à imprensa que o perfil de segurança da CoronaVac também não permite concluir quais os riscos para pacientes nesta faixa etária, em grande parte devido ao número insuficiente de participantes dos estudos que embasaram o pedido do Butantan, feitos na China.
“Faltaram ainda dados que considerassem a vacinação em faixas etárias específicas. Também não é conhecida a eficácia ou a capacidade de indução de resposta imune pela vacina em crianças com comorbidades e imunossuprimidas.”, diz a nota da Anvisa.
Dessa forma, a vacina da Pfizer é a única aprovada para maiores de 12 anos e menores de 18 anos. O laboratório Janssen recebeu autorização para condução de estudos com menores de 18 anos no Brasil.
O Butantan solicitou incluir o público de crianças e adolescentes na faixa de 3 a 17 anos de idade na bula da vacina CoronaVac. Até o momento, a vacina está autorizada para uso emergencial no Brasil para pessoas com 18 anos de idade ou mais, desde o dia 17 de janeiro de 2021 – conforme antecipamos nesta reportagem de junho que o Butantan tinha enviado a documentação à Anvisa para análise da liberação da CoronaVac para crianças acima de 3 anos no Brasil.
Mais novidades: Anvisa recomenda terceira dose experimental
A decisão sobre a utilização da dose de reforço ou uma terceira dose deve ser centralizada e coordenada pelo Programa Nacional de Imunização (PNI) do Ministério da Saúde. Tendo em vista o atual cenário da pandemia no Brasil, a Anvisa decidiu recomendar ao PNI que considere a possibilidade de indicar uma dose de reforço, em caráter experimental, para grupos que receberam duas doses da CoronaVac, priorizando públicos-alvo como pacientes imunocomprometidos ou idosos.
Antes de avançar nos debates sobre doses adicionais, porém, é preciso alertar para a necessidade de ampliação e integralidade da cobertura vacinal a todos os cidadãos aptos, como reforçou a diretora Meiruze Freitas. É prioritário que essa cobertura seja integral, com a aplicação de duas doses ou dose única, conforme a vacina.
Embora a vacinação seja uma das melhores medidas de proteção contra o novo coronavírus, não é possível abrir mão de medidas não farmacológicas, como o uso de máscara de proteção facial, o distanciamento social e a higienização das mãos.
Até hoje, a Anvisa recebeu dois pedidos de autorização para pesquisa clínica a fim de investigar os efeitos de uma dose adicional de imunizantes contra a Covid-19. O primeiro é um estudo da Pfizer/BioNTech que avalia os efeitos, a segurança e o benefício de uma dose de reforço da sua vacina, a Comirnaty.
O segundo caso é o do laboratório AstraZeneca, que desenvolveu uma segunda versão da vacina que está em uso no país, buscando a imunização contra a variante B.1.351 do Sars-CoV-2, identificada primeiro na África do Sul. Um dos braços do estudo prevê que uma dose da nova versão da vacina seja aplicada em pessoas que foram vacinadas com duas doses da versão original da AstraZeneca ou duas doses de uma vacina de RNA mensageiro.
Mantida a autorização de uso emergencial da CoronaVac
Desde a aprovação do uso emergencial até 16 de julho de 2021 foram distribuídas pelo Instituto Butantan 49.172.370 doses da vacina Covid-19 adsorvida – inativada, com o registro de 2.760 eventos adversos notificados até o dia 17 de agosto.
O Relatório Periódico de Avaliação Benefício-Risco, que vai do dia 17 de janeiro a 16 de julho deste ano, não identificou nenhum achado importante que comprometesse a segurança da vacina.
“É preciso ressaltar que a CoronaVac é uma vacina segura, que contribuiu decisivamente para a redução dos danos da pandemia, confirmando que a decisão da autorização de uso emergencial concedida pela Anvisa favoreceu a redução significativa do número de hospitalizações e óbitos da população vacinada. As informações técnicas disponíveis orientam que os benefícios da vacina CoronaVac continuam a superar os riscos de sua utilização”, afirmou Alex Machado, da 5ª Diretoria da Anvisa.
A Diretoria da Anvisa concluiu que a relação benefício-risco da vacina CoronaVac, usada contra a Covid-19, continua favorável, mesmo que o Instituto Butantan não tenha apresentado até o momento todos os dados de imunogenicidade exigidos pela Agência. Por esse motivo, foi mantida a autorização de uso emergencial para a vacina.
Em seu voto, a diretora Meiruze Freitas, relatora da manifestação técnica que avaliou a matéria, considerou que o uso da CoronaVac tem contribuído para a diminuição dos danos da pandemia, favorecendo a redução significativa da hospitalização e dos óbitos da população imunizada.
A ausência de parte dos dados de imunogenicidade tem sido parcialmente superada por outras informações trazidas pelo Butantan ou produzidas pela comunidade científica. Ainda assim, o Instituto não está desobrigado, como foi determinado pela Agência, de apresentar os resultados dos estudos de imunogenicidade, complementando, portanto, o conhecimento quanto à proteção conferida aos cidadãos imunizados. Essa informação é essencial para que se conclua sobre a duração da resposta imunológica garantida pela CoronaVac.
A CoronaVac, desenvolvida pela farmacêutica chinesa Sinovac em parceria com o Instituto Butantan, recebeu autorização temporária de uso emergencial da Anvisa no dia 17/1. A aprovação de vacinas sob essa condição permanece enquanto perdurar a situação de emergência em saúde pública provocada pela pandemia de Covid-19 no Brasil.
A qualquer momento, porém, a autorização temporária para uso emergencial poderá ser modificada, suspensa ou revogada pela Agência, por razões técnicas e científicas que alterem a relação benefício-risco ou com base nas informações provenientes do controle e do monitoramento das vacinas.
Dados de imunogenicidade da CoronaVac
A apresentação do relatório de imunogenicidade é parte do Termo de Compromisso assumido pelo Instituto Butantan quando a Anvisa autorizou o uso emergencial da CoronaVac. Na ocasião, o Butantan comprometeu-se a fornecer os dados até o dia 28/2, mas o prazo foi prorrogado para 30/4, a pedido do Instituto.
Após a análise das informações apresentadas no segundo prazo, a Agência observou que havia informações pendentes. Desde então, vêm sendo realizadas reuniões constantes com o Butantan na tentativa de sanar as lacunas no processo de monitoramento da vacina.
Os testes de imunogenicidade servem para avaliar a capacidade da vacina de estimular a produção de anticorpos no organismo das pessoas vacinadas, além de verificar por quanto tempo essas moléculas permanecem ativas. É comum que estudos de eficácia continuem a ser realizados após a aprovação das vacinas, permitindo que os desenvolvedores coletem informações sobre proteção e segurança enquanto o imunizante estiver sendo amplamente utilizado na população.
Embora a CoronaVac tenha demonstrado proteção significativa contra a hospitalização por Covid-19 e óbitos pela doença, a prevalência de diferentes variantes do coronavírus ao longo do tempo e em locais diferentes pode impactar potencialmente a eficácia observada em ensaios clínicos.
Dessa forma, os estudos do “mundo real” tornam-se vitais, como destacou a diretora Meiruze Freitas em seu voto: “Ao avaliar as vacinas à medida que são usadas, é possível observar sua eficácia e segurança em um número maior de pessoas quando comparado com os testes clínicos. Esses estudos também fornecem uma imagem mais atualizada de como as vacinas estão se saindo contra o vírus e em tempo real”.
Butanvac: como andam os estudos
A Anvisa autorizou, nesta quarta-feira (18/8), a alteração no estudo clínico da vacina Butanvac, que está em fase de desenvolvimento pelo Instituto Butantan. A mudança se refere à substituição do uso de placebo pela vacina CoronaVac na etapa A do estudo. Essa é a etapa inicial do estudo de fase 1 e 2 da Butanvac. Na prática, os voluntários dessa etapa da pesquisa receberão ou a vacina em teste, a Butanvac, ou a vacina de comparação, a CoronaVac, também do Instituto Butantan.
A alteração foi solicitada pelo Instituto Butantan, que, em seu pedido, relatou dificuldades na mobilização de voluntários para o estudo com placebo. A pesquisa clínica de fase 1 e 2 da Butanvac está dividida em três etapas (A, B e C). Neste momento, está autorizada a etapa A do estudo, que vai envolver 400 voluntários. Ao todo, as fases clínicas 1 e 2 têm previsão de seis mil voluntários com 18 anos ou mais.
A vacina será aplicada com duas doses, em um intervalo de 28 dias entre a primeira e a segunda dose. O estudo deve ser realizado no Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP) e no Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto (HCFMRP).
A Agência vem trabalhando ininterruptamente na avaliação de todos os dossiês referentes aos produtos relacionados ao combate à Covid-19 que lhe foram apresentados.
Criado em 19/08/21